Reacciones químicas
Una reacción química, cambio químico o fenómeno químico, es todo proceso termodinámico en el cual una o mássustancias (llamadas reactantes o "reactivos"), se transforman, cambiando su estructura molecular y sus enlaces, en otras sustancias llamadas productos. Los reactantes pueden ser elementos o compuestos. Un ejemplo de reacción química es la formación de óxido de hierro producida al reaccionar el oxígeno del aire con el hierro de forma natural, o una cinta demagnesio al colocarla en una llama se convierte en óxido de magnesio, como un ejemplo de reacción inducida.
A la representación simbólica de las reacciones se les denomina ecuaciones químicas.
Los productos obtenidos a partir de ciertos tipos de reactivos dependen de las condiciones bajo las que se da la reacción química. No obstante, tras un estudio cuidadoso se comprueba que, aunque los productos pueden variar según cambien las condiciones, determinadas cantidades permanecen constantes en cualquier reacción química. Estas cantidades constantes, las magnitudes conservadas, incluyen el número de cada tipo de átomo presente, la carga eléctrica y la masatotal.
tipos de cambios químicos :
| Nombre | Descripción | Representación | Ejemplo |
|---|---|---|---|
| Reacciones de síntesis o de combinación | : Donde los reactivos se combinan entre sí para originar un producto diferente | Se representan mediante la ecuación: A+B→C
Donde A y B son reactivos cuales quiera y C el producto formado.
| 2Na(s) + Cl2(g) → 2NaCl(s) |
| Reacciones de descomposición(pueden ser de 2 tipos): |
|
|
|
| Reacciones de sustitución o desplazamiento | Una sustancia sustituye el lugar de alguno de los componentes de los reactivos, de tal manera que el componente sustituido queda libre. | Se representa por la ecuación: AB +C → AC + B, donde el compuesto químico AB reacciona con el reactivo C para formar el compuesto químico AC y liberar B. | Pb(NO3)2 (ac) + 2 KI (ac) → Pbl2 (s) + 2 KNO3 (ac) |
| Reacciones de doble sustitución (o doble desplazamiento) | Se presenta un intercambio entre los elementos químicos o grupos de elementos químicos de las sustancias que intervienen en la reacción química. | Se representan: AB + CD → AC + BD | Pb(NO3)2 (ac) + 2 KI (ac) → Pbl2 (s) + 2 KNO3 (ac) |
cambios energéticos :
La energía es una propiedad asociada a la materia y se manifiesta en toda transformación que esta sufra. Es decir, las reacciones químicas siempre va asociada de u cambio energético .
Una reacción química que va acompañada de desprendimiento de energía ,por ejemplo la combustión del papel o de la madera , se dice que se es exotermica (depende de energía).
Una reacción que va acompañada de desprendimiento de energía . La reacción absorbe energía ,para que se hay que suministrarse energía es una reacción endotermica (absorbe energía ).Ejemplo la foto síntesis.
Para interpretar los cambios energeticos asociados a las reacciones quimicos , la ciencia utiliza el concepto de entalpia o contenido de calo el cual se simboliza con la letra H .
La diferencia de entalpia entre los productos y los reaccionantes se denomina calor de reaccion y se denota con un triangulo y una H .
En una reaccion exotermica. El calor liberado se debe a que los reaccionantes tiene mayor entalpia que los productos .Por lo tanto el callor de reaccion sera negativo (-). En las reacciones endotermicas el calor de reaccion sera positivo (+) ya que la entalpia de dos productos es mayor que la de los reaccionantes debido al calor suministal .
Una reacción química que va acompañada de desprendimiento de energía ,por ejemplo la combustión del papel o de la madera , se dice que se es exotermica (depende de energía).
Una reacción que va acompañada de desprendimiento de energía . La reacción absorbe energía ,para que se hay que suministrarse energía es una reacción endotermica (absorbe energía ).Ejemplo la foto síntesis.
Para interpretar los cambios energeticos asociados a las reacciones quimicos , la ciencia utiliza el concepto de entalpia o contenido de calo el cual se simboliza con la letra H .
La diferencia de entalpia entre los productos y los reaccionantes se denomina calor de reaccion y se denota con un triangulo y una H .
En una reaccion exotermica. El calor liberado se debe a que los reaccionantes tiene mayor entalpia que los productos .Por lo tanto el callor de reaccion sera negativo (-). En las reacciones endotermicas el calor de reaccion sera positivo (+) ya que la entalpia de dos productos es mayor que la de los reaccionantes debido al calor suministal .
| Criterio | Descripción | Ejemplo |
|---|---|---|
| Si el intercambio de energía es en forma de calor |
| |
| Si el intercambio de energía se realiza en forma de luz |
| |
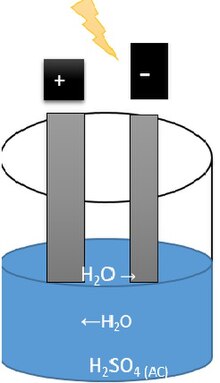
| Si el intercambio de energía es en forma de energía eléctrica |
|
ley de las proporciones definidas
la ley de la conservación de la masa :
Esta ley establece de muestras de un compuesto puro ,siempre contienen los mismos elementos en las mismas proporciones por masa .En otras palabras cuando dos o mas elementos se combinan para formar un compuesto , lo hacen siempre en proporciones constantes de masa .Ejemplo ; el agua esta constituida por dos elementos químicos a hidrógeno y oxigeno .la relación de la masa de hidrógeno a la masa de oxigeno siempre es 1:8 ( 1 a 8 ) independientemente de la fuente de donde provenga el agua .Por lo tanto si se descompone 9g de agua se obtendría un gramo de hidrógeno y 8g de oxigeno ; y si se desintegran 18g de agua se producirían 2g de hidrógeno y 16g de oxigeno .












No hay comentarios:
Publicar un comentario